Желая просто удовлетворить свое любопытство или оказавшись по какой-нибудь причине вдали от цивилизации, где нет ни аккумуляторов, ни батареек, добыть электричество для питания светодиодного фонарика можно при помощи доступных плодов растений: картошки, яблока, апельсина, лимона, лука и т. д. Достаточно иметь под рукой какие-нибудь соединительные провода, и совсем идеально было бы раздобыть вдобавок цинк и медь.
Проверить данную идею можно буквально на коленке: воткните в картофелину с одной стороны медную монетку или кусок медного провода, а с другой стороны — гвоздь или канцелярскую скрепку. При помощи вольтметра у вас тут же получится измерить напряжение в районе 1 вольта между данными электродами.

А суть здесь вот в чем. Клубень картофеля, яблоко, лимон, апельсин и т. д. — от природы содержат в себе не только сложные полезные вещества и витамины, необходимые нашему организму для питания.
Сок данных плодов является еще и природным электролитом, это значит, что в таком соке содержатся кислота и растворенные в ней соли. Следовательно яблоко (даже неспелое и маленькое), картофелину, лимон или апельсин, можно реально применить в качестве составной части химического источника тока, корпус ячейки которого уже готов благодаря самой природе.
Итак, что же происходит, когда мы втыкаем в такой плод с одной его стороны оцинкованный гвоздь, а с другой — медную проволоку, и замыкаем цепь? Гвоздь станет отрицательным электродом — анодом, с него электроны будут утекать в нагрузку, так как в кислой среде начнется реакция окисления цинка с высвобождением электронов. При этом каждый атом цинка отдает по два электрона.
Медь служит здесь катодом — положительным электродом. Медь является сильным окислителем, она притягивает к себе такое же количество электронов, сколько отдает цинк. То есть на катоде протекает химическая реакция восстановления. Так в цепи инициируется протекание электрического тока.
На поверхности меди реакция восстановления протекает так: положительно заряженные ионы водорода, содержащиеся в кислоте, получают недостающие электроны от цинка и превращаются в водород. Водород выходит наружу в виде пузырьков.
Около катода (меди) формируется высокая концентрация отрицательно заряженных ионов кислоты, а около анода (цинка) — положительно заряженных ионов цинка. Ионный обмен между электродами внутри такой батарейки приводит к непрерывной балансировке зарядов в электролите, когда цепь замкнута.
Что касается изначальной разности потенциалов между электродами, (когда цепь разомкнута) то она будет зависеть здесь от двух факторов: от кислотности среды и от разности электрохимических потенциалов металлов, из которых сделаны электроды. Таблица электрохимических потенциалов металлов поможет понять это более наглядно.
Таблица электрохимических потенциалов металлов
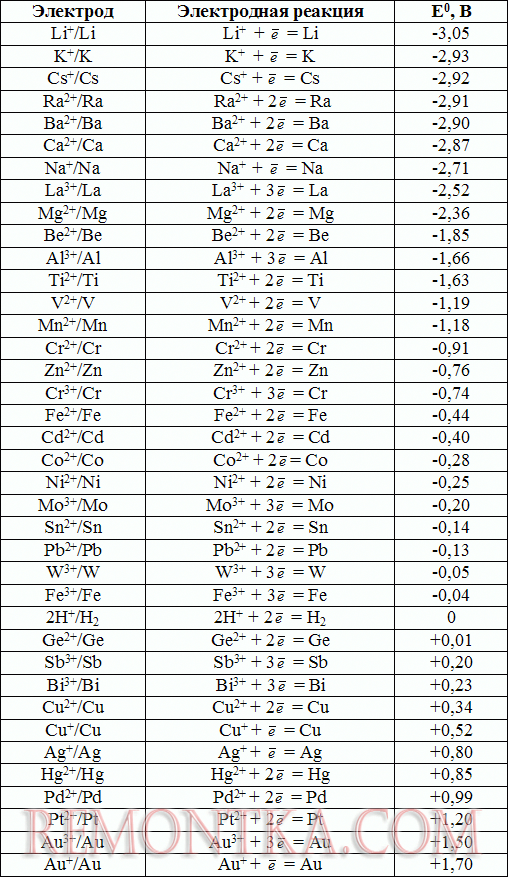
В качестве положительного электрода целесообразно брать металл, стандартный электрохимический потенциал которого положителен относительно водорода (например Cu – медь имеет электрохимический потенциал +0,34 В). Чтобы сделать отрицательный электрод, необходимо взять металл, стандартный электрохимический потенциал которого отрицателен по отношению к водороду ( например Zn – цинк имеет электрохимический потенциал -0,76 В). Разность получается довольно значительной, а именно 1,1 В.

Соединив последовательно несколько таких элементов, можно получить большее напряжение. Чтобы увеличить ток — соединяйте элементы параллельно, при этом используйте электроды по возможности большего размера, чтобы площадь взаимодействия металла с электролитом получилась бы больше, и окислительно-восстановительная реакция могла протекать активнее (смотрите — Схемы соединения аккумуляторов: параллельное и последовательное подключение ).
Известен случай, когда один британский студент на протяжении недели пользовался музыкальным плеером, заряжая его при помощи цинка, меди и лука, пропитанного фруктовым напитком.
Батарейка из картошки:
Зарядка для телефона из лимона:
Информация, опубликованная на данном веб-сайте, представлена исключительно в ознакомительных целях, за применение этой информации администрация сайта ответственности не несет.